药群论坛
标题: FDA丨pre-IND会议流程介绍 [打印本页]
作者: xiaoxiao 时间: 2022-4-19 09:51 AM
标题: FDA丨pre-IND会议流程介绍
、Type B(EOP)、Type C四类,Pre-IND归属于Type B。
6 C9 N* Y- P ? e6 j
03$ s6 H( C6 m/ {3 `4 u, C
会议形式
H/ t$ Y# x; ]! l2 H( m6 k DFDA会议形式包括:面对面、视频会议、电话会议、书面回复。
! F2 O( I3 k1 p+ k1 O9 ]) |
" m5 p3 T4 }: ]& m5 X/ y0 s! f8 o
对于pre-IND申请,FDA通常认为书面回复最合适。特殊情况下可以其他会议形式召开。
1 C0 h7 B7 }9 i/ |
04
会议申请
- E8 ~5 P5 |$ i& F
会议申请材料应清晰表述希望FDA帮助解决的问题。
4 Y, x, T( N- h& g) q2 Z
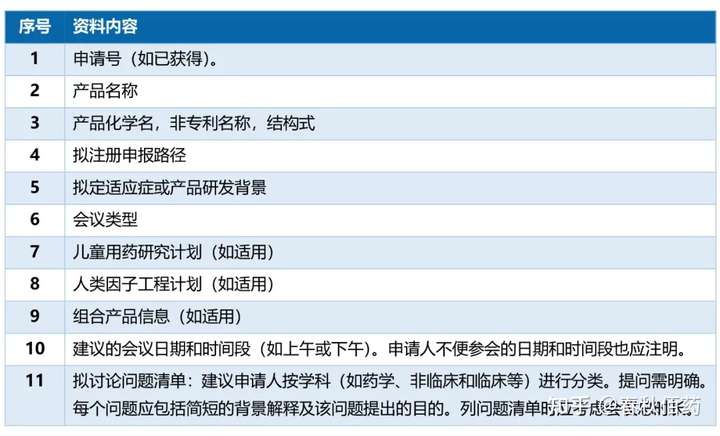
# s% Q% w v5 T$ s" w: o4.1 申请材料应该包括:
! \5 L: S k& B4 N& \6 J
3 B3 k" T' B5 a$ g; U
' W# f$ t V4 V3 q( B$ y
3 r. b9 w9 v: j4.2 申请材料还必须包括:
5 Z4 ?7 {( G. N$ h) v
& D, L) {1 u$ H) b; F" \5 l
; a$ ~' t+ V s2 b( a
9 Z: t1 J5 u5 e1 v7 U4 }会议申请资料通过纸版邮寄或电子通道递交至FDA(传真/邮件文件仅作副本,不作为正式递交文件)。
$ r. ]1 \; w& r; P Y
05
会议申请结果
W! A3 V# E0 AFDA将于收到Pre-IND会议申请后21天内书面回复拒绝或同意会议。
2 j5 u% Q/ B& m1 {2 K" J
# b' k8 Q2 O8 `5.1 拒绝申请
. H" v: F/ w) m! i& M- U
其可能的原因包括:
& r( D7 v& c' p; D# C0 i, Q5.1.1 产品尚处于研发早期,会议申请过早;
5 @+ }5 w8 F2 _7 A: v5.1.2 会议申请资料规定需提交的信息严重欠缺;
4 u: J! ?% a z2 d注:被拒一般会有明确的原因,不会仅因为申请材料稍有欠缺而拒绝。
& f7 L) D! e3 X. g3 }
5.2 同意申请
/ w8 k7 Y2 G% t- d6 s, E) ?
5.2.1 面对面会议/电话会议/视频会议:FDA确定会议日期、时间、会议安排、地址及FDA拟出席会议人员。
" ~0 H V$ A, u4 D- c: _# ^
5.2.2 书面回复:FDA确定书面回复日期。
( O6 r j2 O1 F. B3 ]注:除特殊情况外,FDA一般都会同意Type B会议申请。但除非FDA认为申请人多次会议诉求不相关(比如工艺和临床),需要分次召开会议,否则至多允许同一申请人的同一药物在每个注册阶段申请1次Type B会议(已认定突破性疗法除外)。
3 \ Y$ y# }! w5 i3 |06
会议资料
9 K9 F- d4 A. t会议前至少30天提交会议资料。" w$ T) P* U3 I
& y: J7 {, \! c* f# |
申请人需提交产品总结资料及FDA所需的其他补充信息。提交资料前需考虑是否符合FDA、ICH的相关指南。
4 p2 E6 H, Q6 S2 Q$ C: D1 J6 J
0 S- y4 e, ~3 i- D4 S
) l, H" o, j! a4 p: e) Y3 A( o07
FDA初步审评
u U: T& u# }. z3 V8 SFDA收到会议资料后将进行内部讨论,并于拟定会议日期前至少2天进行首次回复。若申请人认为FDA的首次回复已解决其问题,可联系FDA项目经理(PM)申请取消会议。
+ v* @; F. Q7 x. L' E+ u# t; o) {
08
会议延期/取消
' B$ c% k2 i# l6 w+ \! N8.1 存在下列情形之一的,会议延期:
+ v4 J& N+ }4 [3 T# [0 P5 g+ _
1) 会议资料提交延期。申请人需向PM解释延期理由及何时能提交;
5 C7 @ I3 N! e& A0 \ r
2) FDA认为会议资料不够充分,需要申请人尽快补充资料;
9 X) @4 I7 C9 x$ o) V* Y( w3) 会议资料提交文件量过大,FDA来不及完成审评;
9 |3 N! {* F, D+ _0 G% ~% {4) 会议资料提交后,申请人再次向FDA补充提交需要讨论的其他问题/数据;
?, t8 ?9 u1 e# d+ x1 r; ^5) 关键参会人员无法按时参会。
, r7 [1 V$ f7 C6 W
8.2 存在下列情形之一的,会议取消:
0 G7 ^3 Q0 ^1 I( p4 d% ~: H- T
1) 约定日期前FDA未收到会议资料,或资料准备严重不足;
z _4 x/ J! V/ ?
2) FDA首次回复后,申请人的问题已解决。
+ u# Z1 L( [7 z& n
09
会议召开
: c8 P* p; ~6 u( q) S. F
会议于申请后60天内召开。由FDA工作人员主持,依事先确定的会议议程进行。通常申请人无需准备PPT。如果申请人仍计划在会议中展示PPT,应提前和PM沟通确认是否必须,且需预留足够时间用于问题讨论。PPT应简洁明了。如果PPT中提到了大量会议资料中未涵盖的新增内容,FDA可能不会对此给予评价和建议。
8 r! A' J5 \' ^; b5 U10
会议纪要
" V4 P0 S9 K8 X9 }4 u9 F U会议纪要包括会议共识、分歧、待讨论问题,及经讨论得出的解决方案。FDA将于会议后30天内将会议纪要定稿并发送至申请人,并作为重要文档存档。若申请人阅读会议纪要后发现双方理解存在偏差,可联系PM进行确认。
: e7 g- |1 |, x$ J" ~( [综上,FDA的pre-IND会议流程和要求与国内有相似之处但也存在差别,当申请人计划向FDA申请时需引起注意。
9 e+ |" k6 o, l$ I
参考文献:! X8 T& X0 C9 L; q- z7 p9 k
[1] 药物研发与技术审评沟通交流管理办法, CDE, 2020.
[2] Formal Meetings Between the FDA and Sp**ors or Applicants of PDUFA Products, FDA, 2017.
[3] 21CFR 312.82(a).
[4] Good Review Practice: Best Practices for Communication Between IND Sp**ors and FDA During Drug Development, FDA, 2017.
: S. B3 T/ C+ A6 O. q& P, w5 W8 h
▲来源:有临医药
8 T* t Y9 c2 W; V: c/ F
作者: xiaoxiao 时间: 2022-4-19 09:53 AM
0 S ~! P$ a8 e7 Q; O+ l
| 欢迎光临 药群论坛 (http://www.yaoqun.net/) |
Powered by Discuz! X3.2 |